在现代药物递送技术的不断演进中,脂质体作为一种重要的复杂注射剂,以其独特的结构和功能,在医药研发领域备受瞩目。脂质体的概念最早于 1965 年由 Bangham 等人提出,如今普遍被定义为将磷脂等类脂质分散于水中所形成的具有双分子层包裹水相结构的封闭小囊泡,因其结构与生物膜类似,又被称作人工生物膜。其主要制备原料磷脂是人体细胞的固有组分,这赋予了脂质体良好的生物相容性且无免疫原性。同时,脂质体可制备为纳米级颗粒,更易透过血管壁和细胞膜等生物屏障。
脂质体具有诸多显著优势。在载药范围方面,脂溶性药物可定位在双分子层脂质膜之间,两亲性药物可定位在水相和膜内部交界处的磷脂上,亲水性药物则定位在水相中,实现了广泛的载药能力。给药途径也呈现多样化,除常见的注射给药,还适用于口服、眼部、肺部吸入以及经皮给药等途径。脂质体具备靶向性,普通脂质体具有肝、脾组织靶向性,经单克隆抗体和其他抗体修饰后,可具备特定靶向性。长循环脂质体能够延长药物在血液中的滞留时间,增强药效。凭借与生物膜类似的结构,脂质体拥有良好的细胞亲和性和组织相容性,可长时间吸附在靶细胞周围,甚至直接进入细胞,经溶酶体消化释放药物。此外,药物被脂质体包封后,在心、肾中累积量比游离药物低得多,可降低对心、肾具有毒性的药物的毒性,同时对一些在特定环境中不稳定的药物起到保护作用,提高药物稳定性。
脂质体的制备方法丰富多样,目前主要有以下几种制备技术方法:
1.薄膜水化法:这是较为经典的制备方法。先将磷脂等脂质材料溶解在有机溶剂(如氯仿、甲醇等)中,然后在旋转蒸发仪上减压蒸发除去有机溶剂,使脂质在容器壁上形成一层均匀的薄膜。接着加入含有药物的缓冲溶液,振荡或超声处理,即可形成脂质体。该方法简单易行,应用广泛,在当前脂质体制备中应用占比约28%,能对大多数脂溶性药物实现100%的包封。但该法得到的脂质体粒径分布不均,需要借助整粒手段对粒径进行控制,比如聚碳酸酯膜挤出或者均质技术,此外该方法需要通过全程无菌来保证产品无菌度。
薄膜水化法制取脂质包裹体


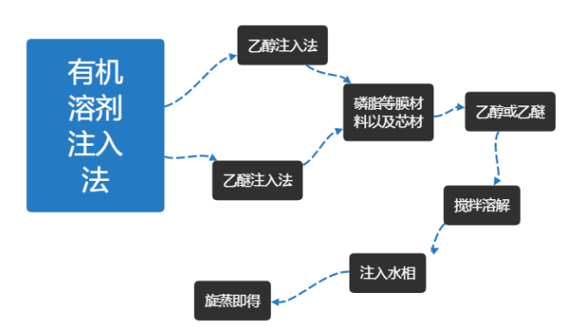
溶剂注入法制取脂质包裹体

逆向蒸发法制取脂质包裹体


5.复乳法:该法先将脂溶性原辅料溶于适量有机溶剂中,按比例加入少量水性溶液,通过机械力(例如搅拌、剪切、超声、震荡)将两者混合乳化,形成状态较为稳定的W/O乳化液,再迅速加入大量水性溶液,混合进行二次乳化处理,形成W/O/W乳化液,再通过物理手段除去残留的有机溶剂,即得到脂质体混悬液。该法所得脂质体一般为多囊泡结构,能实现药物缓释。虽然该法工艺复杂,各工艺参数有效窗窄,但制备的脂质体包封率较高,目前市面上的多囊脂质体即用该法制备。
6.其他方法:除了以上技术还有冻干水化法、钙离子融合法、喷雾干燥法、微流体法等技术。这些技术各有各的特点,但也存在比较明显的缺点,如成本过高或技术不成熟等待那个,还难以满足较大规模的生产需求。如此多的技术也使得脂质体的制备不存在技术问题,更多的问题出现在药物是否适合脂质体这样的载体,哪种方法能更好的包载药物,能否达到理想的体内释放曲线等。因此,对脂质体制备技术的选择,更多的还是需要根据药物来量体裁衣。
脂质体的特殊结构致使稳定性是限制药物递送的重要因素。脂质体的稳定可分为物理稳定性、化学稳定性和生物学稳定性。
1.物理稳定性为维持脂质体囊泡结构的完整,必须要保持脂质体内部及脂质体之间各种相互作用力的平衡。作为热力学不稳定的胶体分散体系,脂质体的囊泡间存在凝聚、絮凝的倾向,而表面电荷可以影响脂质体之间的聚集行为。一般情况下,中性的脂质体易发生囊泡聚集或合并,而拥有强电位的脂质体则因静电相互排斥能维持稳定分散。膜材的种类和用量、载药量、粒径及粒度分布均会影响脂质体的物理稳定性。
2.化学稳定性脂质体的双层膜囊泡主要由磷脂构成,但磷脂含有大量易氧化和水解的官能团(如不饱和双键和酯基),因此脂质体存在易氧化和水解的化学稳定性问题。为避免磷脂氧化和水解,可采用饱和磷脂,不仅有较好的化学稳定性,还具有较高的玻璃化转变温度。如脂质体的处方中不可避免要使用不饱和磷脂,应尽量选择不饱和度低的磷脂,如含有脂肪酸为单不饱和脂肪酸。因脂肪酸的氧化是无需特定氧化剂参与的自由基链式反应,如果存在金属离子或氧形成了过氧化物便会引发氧化反应。因此要尽可能避免使用含有金属离子和过氧化物的材料,也可加入金属离子螯合剂,并且保存条件尽量温和不易发生氧化反应。虽然加入抗氧化剂可以减缓磷脂的氧化,但在脂质体的开发中很少加入抗氧化剂。脂质体的水解是因磷脂酯键的水解,虽然将脂质体混悬液冻干避免与水接触可降低水解程度,但冻干工艺并不适用于所有脂质体产品。胆固醇有稳定脂质体双分子层膜结构的功能,并且可以产生空间位阻效应减缓磷脂水解。此外,外水相的离子强度、缓冲盐的种类、酸碱度等也会影响脂质体的水解。
3.生物学稳定性脂质体的生物学稳定性更多得是因为处方组成和制备工艺,例如在脂质体中聚乙二醇化的磷脂,可以在脂质体表面形成水化膜,避免脂质体被MPS快速识别清除;而适量鞘磷脂的加入也可以提高脂质体的稳定性。



